Valentinio ryšio (VB) teorija yra cheminio jungimosi teorija, paaiškinanti cheminę medžiagą klijavimas tarp dviejų atomai. Kaip ir molekulinės orbitalės (MO) teorija, ji paaiškina sujungimą, naudodama kvantinės mechanikos principus. Remiantis valentinių ryšių teorija, jungimąsi sukelia pusiau užpildyto atomo sutapimas orbitalės. Du atomai pasidalykite vienas kito nesuporuotu elektronu, kad susidarytumėte užpildytą orbitalę, kad susidarytumėte hibridinė orbita ir surišti kartu. Sigma ir pi obligacijos yra valentinių ryšių teorijos dalis.
Pagrindiniai išpardavimai: „Valence Bond“ (VB) teorija
- Valencijos jungčių teorija arba VB teorija yra kvantinės mechanikos pagrįsta teorija, paaiškinanti, kaip veikia cheminis ryšys.
- Valentinių ryšių teorijoje atskirų atomų atominės orbitalės yra sujungiamos, kad sudarytų cheminius ryšius.
- Kita pagrindinė cheminio jungimosi teorija yra molekulinė orbitalės teorija arba MO teorija.
- Valentinių ryšių teorija naudojama paaiškinti, kaip tarp kelių molekulių formuojasi kovalentiniai cheminiai ryšiai.
Teorija
Valentinių ryšių teorija numato kovalentinių ryšių susidarymą tarp atomų, kai jie turi pusiau užpildytus valentinius atominius orbitalius, kurių kiekviename yra vienas neporuotas elektronas. Šie atominiai orbitaliai sutampa, todėl elektronai turi didžiausią tikimybę būti jungties srityje. Tada abu atomai dalijasi pavieniais nesusijtais elektronais, sudarydami silpnai susietas orbitalės.
Du atominiai orbitaliai nebūtinai turi būti vienodi vienas kito atžvilgiu. Pavyzdžiui, sigma ir pi jungtys gali sutapti. Sigmos jungtys susidaro, kai du pasidalinti elektronai turi orbitas, kurios sutampa nuo vienos galvos iki kitos. Priešingai, pi jungtys susidaro, kai orbitalės sutampa, bet yra lygiagrečios viena kitai.
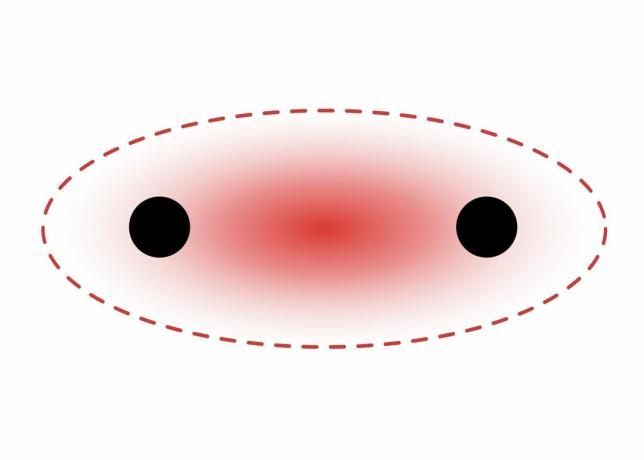
Tarp dviejų s-orbitų elektronų susidaro Sigmos jungtys, nes orbitos forma yra sferinė. Pavienėse obligacijose yra viena sigma. Dvigubus ryšius sudaro sigma ir pi jungtis. Trigubas jungtis sudaro sigma ir dvi pi jungtys. Kai tarp atomų susidaro cheminės jungtys, atominės orbitalės gali būti sigmų ir pi jungčių hibridai.
Teorija padeda paaiškinti jungčių susidarymą tais atvejais, kai a Lewiso struktūra negali apibūdinti tikro elgesio. Tokiu atveju apibūdinti vieną Lewiso striktūrą gali būti naudojamos kelios valentinių ryšių struktūros.
Istorija
Valentinių ryšių teorija remiasi Lewis'o struktūromis. G.N. Lewisas pasiūlė šias struktūras 1916 m., Remdamasis idėja, kad du bendrai jungiantys elektronai sudaro cheminius ryšius. Kvantinė mechanika buvo pritaikyta rišamosioms savybėms apibūdinti 1927 m. Heitlerio-Londono teorijoje. Ši teorija aprašė cheminių jungčių susidarymą tarp vandenilio atomų H2 molekulėje, panaudodama Schrödingerio bangų lygtį, kad būtų sujungti dviejų vandenilio atomų bangos funkcijos. 1928 m. Linus Pauling sujungė Lewiso porų sujungimo idėją su Heitlerio ir Londono teorija, kad pasiūlytų valentinių ryšių teoriją. Valencijos jungčių teorija buvo sukurta apibūdinti rezonansą ir orbitos hibridizaciją. 1931 m. Paulingas išleido valentinių ryšių teorijos straipsnį pavadinimu „Apie cheminio jungties prigimtį“. Pirmos naudotos kompiuterinės programos aprašyti naudojamą molekulinės orbitalės teoriją, tačiau nuo 1980 m. tapo valentinių ryšių teorijos principai programuojamas. Šiandien šiuolaikinės šių teorijų versijos konkuruoja tarpusavyje tiksliai apibrėždamos tikrąjį elgesį.
Panaudojimas
Valentinių ryšių teorija dažnai gali paaiškinti, kaip kovalentiniai ryšiai forma. diatominė fluoro molekulė, F2, yra pavyzdys. Fluoro atomai sudaro vienas su kitu kovalentinius ryšius. F-F jungtis atsiranda dėl sutapimo pz orbitalės, kurių kiekvienoje yra vienas nesuporuotas elektronas. Panaši situacija yra ir vandenilyje, H2, tačiau jungčių ilgis ir stipris yra skirtingi tarp H2 ir F2 molekulės. Tarp vandenilio ir fluoro susidaro kovalentinis ryšys vandenilio fluorido rūgštyje (HF). Ši jungtis susidaro dėl vandenilio 1 sutapimos Orbita ir fluoras 2pz orbitalė, kurioje kiekvienas turi nesuporuotą elektroną. Esant HF, vandenilio ir fluoro atomai dalijasi šiais elektronais kovalentiniame ryšyje.
Šaltiniai
- Cooperis, Davidas L.; Gerratas, Juozapas; Raimondi, Mario (1986). "Benzeno molekulės elektroninė struktūra". Gamta. 323 (6090): 699. doi:10.1038 / 323699a0
- Mesmeris, Richardas P.; Schultzas, Petras A. (1987). "Benzeno molekulės elektroninė struktūra". Gamta. 329 (6139): 492. doi:10.1038 / 329492a0
- Murrell, J.N.; Kettle, S.F.A.; Tedderis, J. M. (1985). Cheminis obligacija (2-asis leidimas). Johnas Wiley ir sūnūs. ISBN 0-471-90759-6.
- Paulingas, Linus (1987). "Elektroninė benzeno molekulės struktūra." Gamta. 325 (6103): 396. doi:10.1038 / 325396d0
- Shaik, Sasonas S.; Phillipe C. „Hiberty“ (2008). Valento Bondo teorijos chemijos vadovas. Naujasis Džersis: „Wiley-Interscience“. ISBN 978-0-470-03735-5.