Fosforija yra liuminescencija, atsirandanti, kai energija tiekia elektromagnetinė radiacija, paprastai ultravioletinė šviesa. Energijos šaltinis išmeta elektroną atomas iš žemesnės energijos būsenos į „sužadintą“ aukštesnės energijos būseną; tada elektronas išskiria energiją pavidalu matoma šviesa (liuminescencija), kai ji grįžta į mažesnės energijos būseną.
Pagrindiniai išpardavimai: fosforizacija
- Fosporizmas yra fotoliuminescencijos rūšis.
- Fosporizuojant šviesą sugeria medžiaga, pakeldama elektronų energijos lygius į sužadintą būseną. Tačiau šviesos energija ne visai sutampa su leistinų sužadintų būsenų energija, todėl sugertos nuotraukos įstrigo triguboje būsenoje. Perėjimai į žemesnę ir stabilesnę energijos būseną užtrunka, tačiau kai jie įvyksta, šviesa išsiskiria. Kadangi šis išsiskyrimas vyksta lėtai, atrodo, kad fosforizuojanti medžiaga švyti tamsoje.
- Fosporuojančių medžiagų pavyzdžiai yra švytinčios tamsoje žvaigždės, kai kurie saugos ženklai ir švytintys dažai. Skirtingai nuo fosforescuojančių produktų, fluorescenciniai pigmentai nustos švyti pašalinus šviesos šaltinį.
- Nors fosforas pavadintas žaliuoju fosforo švytėjimu, jis iš tikrųjų švyti dėl oksidacijos. Tai nėra fosforescuojanti medžiaga!
Paprastas paaiškinimas
Fosforizmas laikui bėgant lėtai išskiria kaupiamą energiją. Iš esmės fosforuojanti medžiaga yra „įkraunama“ ją veikiant šviesai. Tada energija tam tikrą laiką kaupiama ir lėtai išleidžiama. Kai energija išleidžiama iškart po to, kai sugeria kritusią energiją, procesas vadinamas fluorescencija.
Kvantinės mechanikos paaiškinimas
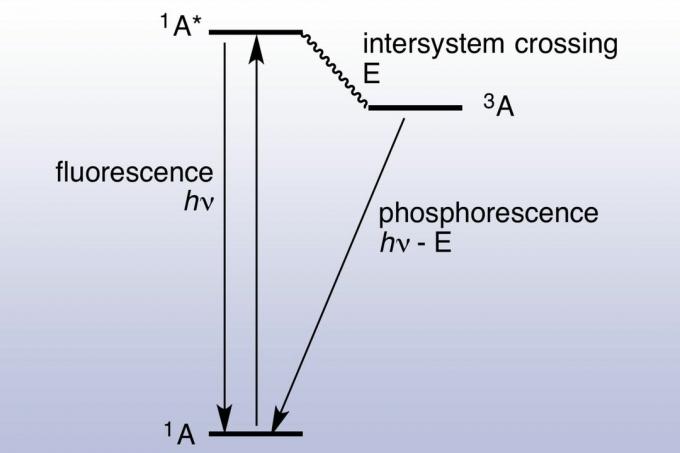
Fluorescenciniu būdu paviršius absorbuojamas ir pakartotinai skleidžia fotoną beveik akimirksniu (apie 10 nanosekundžių). Fotoliuminescencija yra greita, nes absorbuotų fotonų energija sutampa su energijos būsenomis ir leistinomis medžiagos perėjimais. Fosporizmas trunka daug ilgiau (milisekundės iki dienų), nes absorbuotas elektronas pereina į sužadintą būseną su didesniu sukimosi dauginimu. Sujaudinti elektronai įstrigę trigubos būsenoje ir gali naudoti tik „draudžiamus“ perėjimus, kad nukristų į žemesnės energijos singuliarinę būseną. Kvantinė mechanika leidžia uždraustą perėjimą, tačiau jie nėra kinetiškai palankūs, todėl jie trunka ilgiau. Jei sugeriama pakankamai šviesos, saugoma ir skleidžiama šviesa tampa pakankamai reikšminga, kad medžiaga galėtų "švytėti tamsi. “Dėl šios priežasties fosforescuojančios medžiagos, kaip ir fluorescencinės medžiagos, atrodo labai ryškios esant juodai (ultravioletiniams) spinduliams. Jablonski diagrama dažniausiai naudojama parodyti skirtumą tarp fluorescencijos ir fosforescencijos.
Istorija
Fosporuojančių medžiagų tyrimas pradėtas mažiausiai 1602 m., Kai italas Vincenzo Casciarolo aprašė „lapis solaris“ (saulės akmuo) arba „lapis lunaris“ (mėnulio akmuo). Šis atradimas aprašytas filosofijos profesoriaus Giulio Cesare la Galla 1612 m. Knygoje „De Fenomenis“ Orbe Lunae. La Galla praneša, kad Casciarolo akmuo skleidė šviesą po to, kai jis buvo kalcifikuotas kaitinant. Jis gaudavo saulės spindulius, tada (kaip ir Mėnulis) skleidė šviesą tamsoje. Akmuo buvo nešvarus baritas, nors kiti mineralai taip pat pasižymi fosforescencija. Jie apima kai kuriuos deimantai (Indijos karaliui Bhojui žinomas jau 1010–1055 m., iš naujo aptiktas Albertus Magnusas ir vėl iš naujo atrastas Roberto Boyle'o) ir baltasis topazas. Visų pirma, kinai vertino fluorito tipą, vadinamą chlorofanu, kuris atspindėtų liuminescenciją nuo kūno šilumos, šviesos poveikio arba būtų trinamas. Susidomėjimas fosforescencijos ir kitų tipų liuminescencijos pobūdžiu galiausiai paskatino radioaktyvumo atradimą 1896 m.
Medžiagos
Be kelių natūralių mineralų, fosforą sukuria cheminiai junginiai. Tikriausiai labiausiai žinomas iš jų yra cinko sulfidas, kuris gaminiuose buvo naudojamas nuo 1930-ųjų. Cinko sulfidas paprastai skleidžia žalią fosforą, nors fosforo gali būti pridedama keičiant šviesos spalvą. Fosforos sugeria fosforescencijos skleidžiamą šviesą ir tada ją išskiria kaip kitą spalvą.
Pastaruoju metu stroncio aliuminatas naudojamas fosforescencijai. Šis junginys švyti dešimt kartų ryškiau nei cinko sulfidas, be to, daug ilgiau kaupia savo energiją.
Fosporizacijos pavyzdžiai
Įprasti fosforescencijos pavyzdžiai yra žvaigždės, kurias žmonės uždeda ant miegamojo sienų, kurios valandas švyti po to, kai užsidega lemputė, ir dažai, naudojami žėrinčioms žvaigždžių freskoms gaminti. Nors elementas fosforas švyti žalia spalva, šviesa išsiskiria iš oksidacijos (chemiliuminescencijos) ir yra ne fosforescencijos pavyzdys.
Šaltiniai
- Franzas, Karlas A.; Kehr, Wolfgang G.; Siggelis, Alfredas; Wieczoreck, Jürgen; Adomas, Waldemaras (2002). "Liuminescencinės medžiagos" Ullmanno pramoninės chemijos enciklopedija. Vilis-VCH. Weinheimas. doi: 10.1002 / 14356007.a15_519
- Roda, Aldo (2010). Chemiliuminescencija ir bioliuminescencija: praeitis, dabartis ir ateitis. Karališkoji chemijos draugija.
- Zitoun, D.; Bernaud, L.; Manteghetti, A. (2009). Ilgalaikio fosforo sintezė mikrobangų krosnelėje. Dž. Chem. Edukacija. 86. 72-75. doi: 10.1021 / ed086p72