Atominė ir molekulinė struktūra
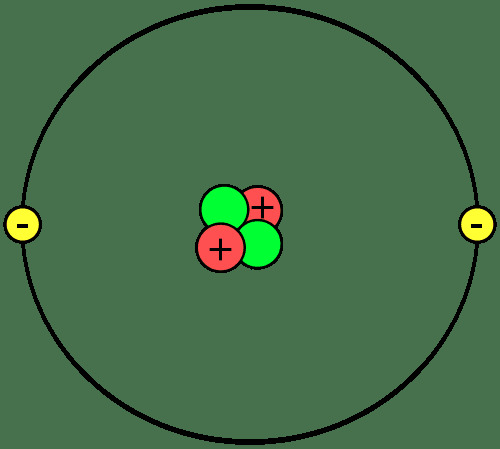
Medžiagos statybiniai blokai yra atomai, kurie sujungti sudaro molekules ar junginius. Svarbu žinoti atomo dalis, kas yra jonai ir izotopai ir kaip atomai susijungia.
Atomo dalys
Atomai yra sudaryti iš trijų komponentų:
- protonai - teigiamas elektros krūvis
- neutronai - be elektros krūvio
- elektronai - neigiamas elektros krūvis
Protonai ir neutronai sudaro kiekvieno atomo branduolį arba centrą. Elektronai skrieja aplink branduolį. Taigi, kiekvieno atomo branduolys turi grynąjį teigiamą krūvį, o išorinė atomo dalis turi grynąjį neigiamą krūvį. Atliekant chemines reakcijas, atomai praranda, įgyja arba dalijasi elektronus. Branduolys nedalyvauja įprastose cheminėse reakcijose, nors branduolio irimas ir branduolinės reakcijos gali sukelti pokyčius atominiame branduolyje.
Atomai, jonai ir izotopai
Protonų skaičius atomyje lemia, kuris elementas jis yra. Kiekvienas elementas turi vieną ar dvi raides
simbolis kuris naudojamas jį identifikuoti cheminėse formulėse ir reakcijose. Helio simbolis yra Jis. Atomas su dviem protonais yra helio atomas, nepriklausomai nuo to, kiek neutronų ar elektronų jis turi. Atomas gali turėti tą patį protonų, neutronų ir elektronų skaičių arba neutronų ir (arba) elektronų skaičius gali skirtis nuo protonų skaičiaus.Atomai, turintys grynąjį teigiamą ar neigiamą elektros krūvį, yra jonai. Pvz., Jei helio atomas praranda du elektronus, jo grynasis krūvis būtų +2, kuris būtų parašytas He2+.
Keičiant neutronų skaičių atome, nustatoma, kuris izotopas elemento, koks jis yra. Atomai gali būti užrašomi branduoliniais simboliais, kad būtų galima identifikuoti jų izotopą, kur yra nukleonų (protonų ir neutronų) skaičius. yra išvardytas aukščiau ir kairėje nuo elemento simbolio, nurodant protonų skaičių žemiau ir kairėje nuo simbolis. Pavyzdžiui, trys vandenilio izotopai yra:
11H, 21H, 31H
Kadangi žinote, kad protono skaičius niekada nesikeičia elemento atomo atžvilgiu, izotopai dažniausiai rašomi naudojant elemento simbolį ir nukleonų skaičių. Pvz., Galite parašyti H-1, H-2 ir H-3 trims vandenilio izotopams arba U-236 ir U-238 dviem įprastam urano izotopui.
Atominis skaičius ir atominis svoris
atominis skaičius atomo identifikuoja jo elementą ir protonų skaičių. atominis svoris yra protonų skaičius ir neutronų skaičius elemente (nes elektronų masė yra tokia maža, palyginti su protonų ir neutronų mase, kad ji iš esmės neskaičiuojama). Atomo masė kartais vadinama atomine mase arba atominės masės skaičiumi. Helio atominis skaičius yra 2. Helio atominis svoris yra 4. Atminkite, kad periodinės lentelės elemento atominė masė nėra sveikas skaičius. Pavyzdžiui, helio atominė masė yra 4,003, o ne 4. Taip yra todėl, kad periodinė lentelė atspindi natūralią elemento izotopų gausą. Chemijos skaičiavimuose naudojate periodinėje lentelėje nurodytą atominę masę, darant prielaidą, kad elemento pavyzdys atspindi natūralų to elemento izotopų diapazoną.
Molekulės
Atomai sąveikauja tarpusavyje, dažnai sudarydami cheminius ryšius. Kai du ar daugiau atomų jungiasi vienas su kitu, jie sudaro molekulę. Molekulė gali būti paprasta, tokia kaip H2arba sudėtingesni, tokie kaip C6H12O6. Indeksai nurodo kiekvieno tipo atomo molekulėje skaičių. Pirmasis pavyzdys apibūdina molekulę, sudarytą iš dviejų vandenilio atomų. Antrasis pavyzdys apibūdina molekulę, kurią sudaro 6 anglies atomai, 12 vandenilio atomų ir 6 deguonies atomai. Atomus galite rašyti bet kuria tvarka, tačiau pirmiausia reikia parašyti teigiamai įkrautą molekulės praeitį, o paskui - neigiamai įkrautą molekulės dalį. Taigi, natrio chloridas yra NaCl, o ne ClNa.
Periodinės lentelės pastabos ir apžvalga
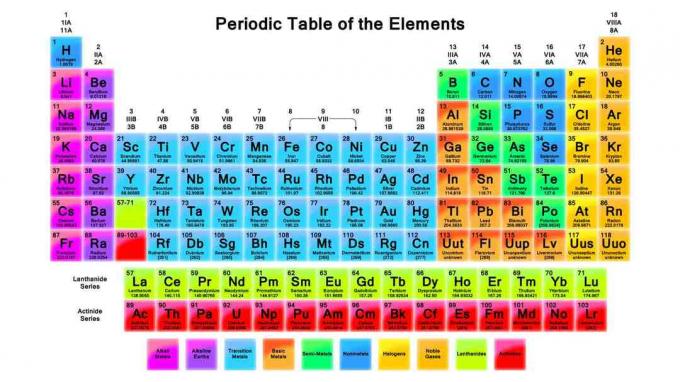
Periodinė lentelė yra svarbi chemijos priemonė. Šiose pastabose apžvelgiamos periodinės lentelės, jos struktūros ir periodinės lentelės tendencijos.
Periodinės lentelės išradimas ir organizavimas
1869 m. Dmitrijus Mendelejevas cheminius elementus suskirstė į periodinę lentelę panašiai kaip tą, kurią naudojame šiandien, išskyrus jo elementus buvo užsakomi atsižvelgiant į didėjantį atominį svorį, o šiuolaikinė lentelė organizuojama didinant atominę skaičius. Elementų išdėstymo būdas leidžia pamatyti elementų savybių tendencijas ir numatyti elementų elgseną cheminėse reakcijose.
Eilutės (judančios iš kairės į dešinę) yra vadinamos laikotarpiai. Laikotarpio elementai turi tą pačią aukščiausią neišnaudoto elektrono energijos lygį. Didėjant atomo dydžiui, daugiau energijos lygių yra viename energijos lygyje, taigi laikotarpiuose, esančiuose žemiau lentelės, yra daugiau elementų.
Stulpeliai (judantys iš viršaus į apačią) sudaro elemento pagrindą grupes. Elementai grupėse turi tą patį valentinių elektronų skaičių arba išorinį elektronų apvalkalo išdėstymą, o tai suteikia grupės elementams keletą bendrų savybių. Elementų grupių pavyzdžiai yra šarminiai metalai ir tauriosios dujos.
Periodinės lentelės tendencijos arba periodiškumas
Periodinės lentelės organizavimas leidžia iš pirmo žvilgsnio pamatyti elementų savybių tendencijas. Svarbios tendencijos yra susijusios su atomo spinduliu, jonizacijos energija, elektronegatyvumu ir elektronų giminingumu.
-
Atomo spindulys
Atomo spindulys atspindi atomo dydį. Atomo spindulys sumažėja judant iš kairės į dešinę per visą laikotarpį ir padidėja judėjimas iš viršaus į apačią žemyn elementų grupė. Nors galite manyti, kad atomai tiesiog padidės, nes įgys daugiau elektronų, elektronai lukšte išliks, o didėjantis protonų skaičius pritraukia apvalkalus arčiau branduolio. Judėdami grupele, elektronai randami toliau nuo branduolio naujuose energijos apvalkaluose, taigi bendras atomo dydis padidėja. -
Jonizacijos energija
Jonizacijos energija yra energijos kiekis, reikalingas elektronui pašalinti iš jonų ar atomo dujų būsenoje. Jonizacijos energija padidėja judant iš kairės į dešinę per visą laikotarpį ir sumažėja judant iš viršaus į apačią žemyn grupei. -
Elektronegatyvumas
Elektronegatyvumas yra matas, kaip lengvai atomas suformuoja cheminį ryšį. Kuo didesnis elektronegatyvumas, tuo didesnė traukos priemonė elektronui surišti. Elektronegatyvumas sumažėja judant žemyn elementų grupei. Elementai kairėje periodinės lentelės pusėje yra linkę į elektropozitiviškumą arba labiau linkę paaukoti elektroną nei priima. -
Elektronų afinitetas
Elektronų giminingumas parodo, kaip lengvai atomas priims elektroną. Elektronų giminingumas skiriasi priklausomai nuo elementų grupės. Tauriųjų dujų elektronų giminingumas yra artimas nuliui, nes jie užpildė elektronų apvalkalus. Halogenai turi aukštą elektronų afinitetą, nes pridedant elektroną atomas gauna visiškai užpildytą elektronų apvalkalą.
Cheminės jungtys ir klijavimas

Cheminiai ryšiai yra lengvai suprantami, jei reikia atsiminti šias atomų ir elektronų savybes:
- Atomai siekia stabiliausios konfigūracijos.
- Okteto taisyklė teigia, kad atomai, kurių išorinėje orbitoje yra 8 elektronai, bus stabiliausi.
- Atomai gali dalytis, duoti ar paimti kitų atomų elektronus. Tai yra cheminių jungčių formos.
- Ryšiai įvyksta tarp atomų valentinių elektronų, o ne vidinių elektronų.
Cheminių jungčių tipai
Du pagrindiniai cheminių jungčių tipai yra joninės ir kovalentinės jungtys, tačiau turėtumėte žinoti apie keletą jungčių formų:
-
Joninės jungtys
Joninės jungtys forma, kai vienas atomas perima elektroną iš kito atomo. Pavyzdys: NaCl susidaro dėl joninės jungties, kur natris savo valentės elektroną paaukoja chloru. Chloras yra halogenas. Visi halogenai turi 7 valentinius elektronus ir norint gauti stabilų oktetą, reikia dar vieno. Natris yra šarminis metalas. Visi šarminiai metalai turi 1 valentinį elektroną, kurį jie lengvai paaukoja, kad sudarytų ryšį. -
Kovalentinės obligacijos
Kovalentiniai ryšiai forma, kai atomai dalijasi elektronais. Tikrai pagrindinis skirtumas yra tai, kad jonų jungtyse esantys elektronai yra labiau susiję su vienu atomu branduolys ar kitas, kurių kovalentinėje jungtyje esantys elektronai yra maždaug vienodai linkę skrieti aplink vieną branduolį kaip ir kita. Jei elektronas yra labiau susijęs su vienu atomu nei kitas, a poliarinė kovalentinė jungtis gali susiformuoti. Pavyzdys: Kovalentiniai ryšiai susidaro tarp vandenilio ir deguonies vandenyje, H2O. -
Metalinis obligacija
Kai abu atomai yra metalai, susidaro metalinis ryšys. Metalas skiriasi tuo, kad elektronai gali būti bet kuris metalo atomas, o ne tik du atomai junginyje. Pavyzdys: Grynų elementinių metalų, tokių kaip auksas ar aliuminis, lydinių, tokių kaip žalvaris ar bronza, pavyzdžiuose matomi metaliniai ryšiai.
Jums gali būti įdomu, kaip galite sužinoti, ar jungtis yra joninė, ar kovalentinė. Galite pasižiūrėti elementų išdėstymą ant periodinės lentelės arba elementų lentelės elektronegatyvumas numatyti, koks bus jungties tipas. Jei elektronegatyvumo reikšmės labai skiriasi viena nuo kitos, susidarys joninė jungtis. Paprastai katijonas yra metalas, o anijonas - nemetalo. Jei abu elementai yra metalai, tikimasi, kad susiformuos metalo jungtis. Jei elektronegatyvumo vertės yra panašios, tikimasi, kad susiformuos kovalentinis ryšys. Tarp dviejų nemetalų esančios obligacijos yra kovalentinės obligacijos. Tarp elementų, turinčių tarpinius skirtumus tarp elektronegatyvumo verčių, susidaro poliniai kovalentiniai ryšiai.
Kaip pavadinti junginius - chemijos nomenklatūra
Kad chemikai ir kiti mokslininkai galėtų susisiekti vieni su kitais, Tarptautinė grynos ir taikomosios chemijos sąjunga arba IUPAC susitarė dėl nomenklatūros arba pavadinimų sistemos. Išgirsite chemikalus, vadinamus jų bendraisiais pavadinimais (pvz., Druska, cukrus ir kepimo soda), tačiau laboratorijoje naudosite sisteminius pavadinimus (pvz., Natrio chloridas, sacharozė ir natrio bikarbonatas). Štai keletas pagrindinių nomenklatūros klausimų.
Dvinarių junginių pavadinimai
Junginius gali sudaryti tik du elementai (dvejetainiai junginiai) arba daugiau nei du elementai. Pavadinant dvejetainius junginius, taikomos tam tikros taisyklės:
- Jei vienas iš elementų yra metalas, jis įvardijamas pirmiausia.
- Kai kurie metalai gali sudaryti daugiau nei vieną teigiamą joną. Įprasta, kad krūvis ant jonų nurodomas romėniškais skaitmenimis. Pavyzdžiui, FeCl2 yra geležies (II) chloridas.
- Jei antrasis elementas yra nemetalinis, junginio pavadinimas yra metalo pavadinimas, po kurio eina nemetalinio vardo kamienas (santrumpa), po kurio eina „ide“. Pavyzdžiui, NaCl yra vadinamas natrio chloridu.
- Junginiams, sudarytiems iš dviejų nemetalų, pirmiausia nurodomas elektropozityviausias elementas. Įvardijamas antrojo elemento kamienas, po kurio rašoma „ide“. Pavyzdys yra HCl, kuris yra vandenilio chloridas.
Joninių junginių įvardijimas
Be dvejetainių junginių įvardijimo taisyklių, yra ir papildomų joninių junginių įvardijimo konvencijų:
- Kai kuriuose poliaatominiuose anijonuose yra deguonies. Jei elementas suformuoja du oksianionus, vienas, kuriame mažiau deguonies, pasibaigia viduje, o kitas, kuriame daugiau oxgyen, baigiasi -ate. Pavyzdžiui:
NE2- yra nitritas
NE3- yra nitratas